本期的分享主题还是与医药相关,分享者是投资聚义厅的陈总。
陈总9年前在校期间加入聚义厅,令兄弟们印象无比深刻的是,他当时号称自己已经有10年股龄。也就是说这家伙小学五六年级就开始炒股了。
入伙不久后,他给我们分享了上初中就下手买的一只股票:片仔癀。然后用他那白板背景和宋体初号的PPT,给我们展示了如果按照正常的林麝繁殖速度,片仔癀将在2017年实现麝香的完全自给,然后每年提价的话到时候有多少利润。

陈总的人设本来是非常精英路线的:在校期间就是学霸绩点、复合背景、英语流利(曾在新东方兼职授课的水平)、交友广泛,拿到的实习也都是外资投行/美元基金这类机会,毕业后又顺理成章去了香港的国际买方看医药。
但在股票上,他有时候又会有一些和人设完全不符的偏好,比如有段时间极其痴迷【缠中说禅】,还有段时间不遗余力给我们推销他钻研十多年的K线战法【涨停跌光】。
这些接地气又富有实用主义的操作都表明,他是非常热爱股票投资的。
上篇里我们说了,聚义厅看医药的优秀兄弟很多,但大家都公认Jerry为最强一哥,但陈总表示不服。他俩人本科都是我们学校生科专业,相邻一届而且各自都是班上的第一名,还偏偏都看医药。这十年来他俩日常表达兄弟情的方式就是互怼互黑、相爱相杀,每次看他们互相diss对方的股票时,群里都充满了欢乐的氛围。
陈总这次分享的主题叫《中国式创新药投资》,本来写完后自我感觉良好,结果上周看到Jerry的《医药投资不玩深度价值》口碑甚好,他颇为紧张,连夜问我咋整。我说你这主题有点专业,而且稿子流畅度确实不如药神,要不我们换个方式,我来帮你带带节奏。
所以今天有请已经20年股龄的陈总,以QA的方式,聊聊中国式创新药投资。
——宝哥
1
药品市场的颠覆性变化
宝哥:2015年医药改革后,你感受最大的变化是哪些?
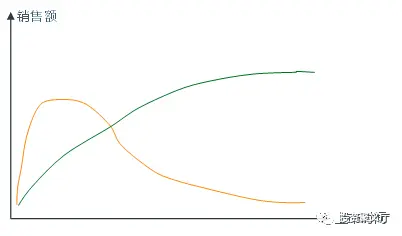
陈总:首先是仿制药特别惨,生命周期急剧缩短。以前仿制药高度依赖于销售能力,单品的生命周期类似成长性品种,通常通过5-7年到达峰值(图中的绿线),且竞争格局长期稳定。
结果2018年英明神睿的国家医保局出台了4+7带量采购,仿制药的生命周期变为1-2年达峰(图中的黄线),并且一旦第三家或更多仿制药企业上市后,销售就会迅速萎缩。
然后是以前的一批【创新药】也很难玩了。历史上很长一段时间,中国特色创新药都因为独家品种的地位在招标过程中获取了超额利润,并且形成了高价高费用的不合理玩法,各地医保各自为政,允许省医保目录增补的行为更是为这种玩法创造了资金支持。
随着国家医保局收紧医保目录制定大权,并且在3年内省医保增补逐步取消,这种中国特色微创新、伪创新药物的定价是很危险的。
这两年网络上一次次出现医保局灵魂砍价视频,从投资人到老百姓都见识了医保局的砍价能力。在目前支付体系里国家医保独大的局面下,企业如果丢失医保资格,意味着在医院准入、患者获取上相对于竞争对手的远远落后,这是承担不起的。
宝哥:这两年很火的PD1这类创新药给的估值那么高,怎么看他们的降价风险?
**陈总:**这种可能是有的,同靶点药物未来是否会采取竞争性谈判是一个决定创新药估值的重要因素。中国目前的创新以me too为主,初期又都以低风险策略选择确定性高的适应症开发,这就决定了这些药物最后的临床效果类似,临床价值趋同。
举个例子:2019年的医保谈判中,首次引入了竞争性谈判机制。6种丙肝药物疗效都非常显著的情况下,最后Gilead的索磷布韦与MSD的格拉瑞韦降价85%中选,而歌礼因为联用干扰素的成本偏高,无奈落选。
其实医保局完全可以支持国产创新,用议价谈判的传统路径,让歌礼的产品进入医保。但是在权衡了医保基金支出与扶持国产创新之后,还是选择了前者。
再举一个例子:阿斯利康的氟维司群是治疗激素受体阳性乳腺癌的内分泌疗法中的基石药物,17年成功通过创新药谈判纳入。在19年的续约谈判中,却由于达不到医保局的要求降幅而被剔除医保资质。
这样一个在临床路径上毫无争议的治疗性药物都能被踢出医保,所以我说千万不要低估医保局控制支出的坚定信念。
今明两年的医保谈判将会迎来一些热门药物的热门适应症出现3家以上产品获批的情形,比如VEGFR注射剂的黄斑变性适应症、PD1的肺癌适应症、BTK的CLL/MCL适应症,到时候医保谈判会通过何种方式来控制支出,我们拭目以待。
2
新时代如何评估药企竞争力
宝哥:中国所有的存量药企,在2018年以前基本都是仿制药企业,竞争力大多在渠道上。现在已经明确创新是唯一出路,那么这时候怎么去评估企业的核心竞争力?原来的护城河在未来竞争中哪些依然有效?
**陈总:**我觉得主要考察自主研发、药物引进、销售这三个能力。
先说自主研发。一个药物研发主要分三个阶段:(1)分子发现(2)临床前评估(3)临床阶段评估。
(1)分子发现阶段比拼的是技术平台的效率,也即如何用尽量快的速度,尽量小的成本筛选出对靶点作用最强的分子。这个阶段的评判标准也比较清晰,方法学上各家技术平台略有差异。
(2)临床前评估。从上一步发现的众多分子中挑选最有竞争力的1-2个进入临床。这里面要评估的是①该靶点的生物学特性;②亲和力,效价;③成药性。
由于下一步的临床开发成本很高,动辄几亿,临床前筛选对防止后面出现南辕北辙的临床资源浪费,起着事半功倍的效果。在这三个评价指标中,后两个比较客观且标准化,而生物学特性的理解各有千秋,是一项及其重要的软实力。
(3)之后就进入长达5年以上的临床阶段。这里面也分不同阶段。以肿瘤药物开发为例,一般来说会涉及一期临床的剂量爬坡,剂量扩展(找到可能有效的瘤种),二期临床的proof of concept验证靶点有效性,以及最后的注册临床。
注册临床试验展示的有效性和安全性是衡量药物的金标准。在从一期到注册临床的阶段中,除了排除一些明显无法达标的分子(有效性实在太差,或者剂量安全窗太窄,不可接受的毒副作用),更多的是在进行风险的权衡,经常会面临的灵魂拷问包括:
①早期临床数据的临床药理认知;
②横向比较同靶点或同适应症竞品的临床数据,自己的分子有什么差异性;
③目标病人群体的选择:是否需要筛选生物标记物?更精准的病人定位意味着更高的成功率,但也削弱了商业化价值;
④制定注册临床路径,盘算下后面要花多少钱,商业化阶段的收益如何。
宝哥:对于股票投研来说,你是要去搜集标的公司新药在各个阶段的数据,然后自己去评估这个药的商业价值和做成的概率吗?还是说先验的相信某些公司就是具备这方面能力的?
陈总:这个需要自己搜集和评估,如果要看得深是巨大的工作量,一般就看每个公司最牛逼的几个pipeline。
宝哥:这听起来已经非常复杂了。那直接做产品引进是不是会容易一些?介绍一下这个商业模式。
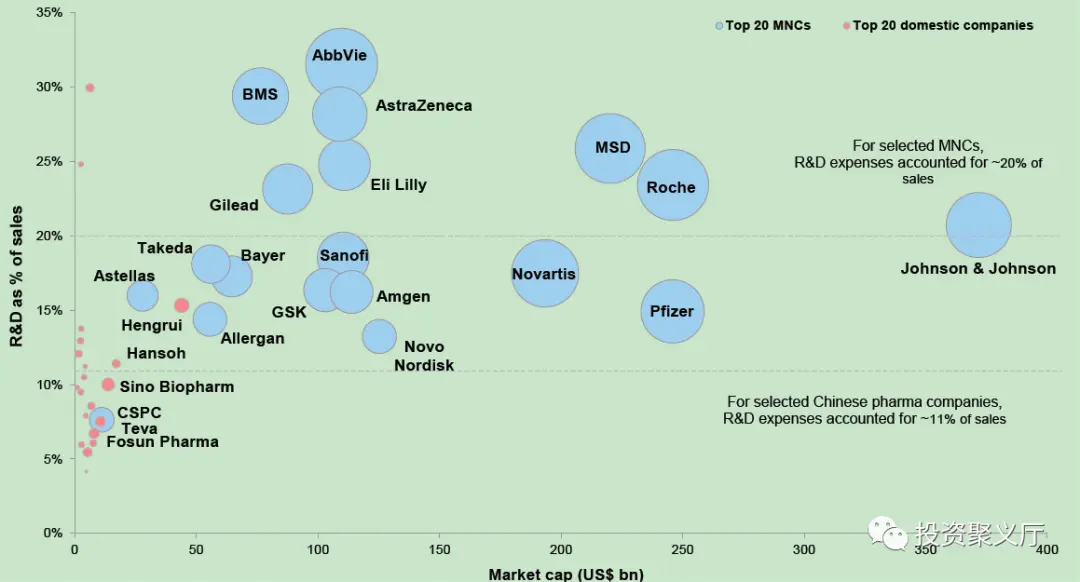
陈总:各家跨国药企在全球维度的竞争中,产品线在不同的适应症各有优劣,形成了各自的比较优势。但是毫无疑问的是,在绝大多数的靶点开发上,国内创新药企业无论在疗效和开发速度上都是落后的。
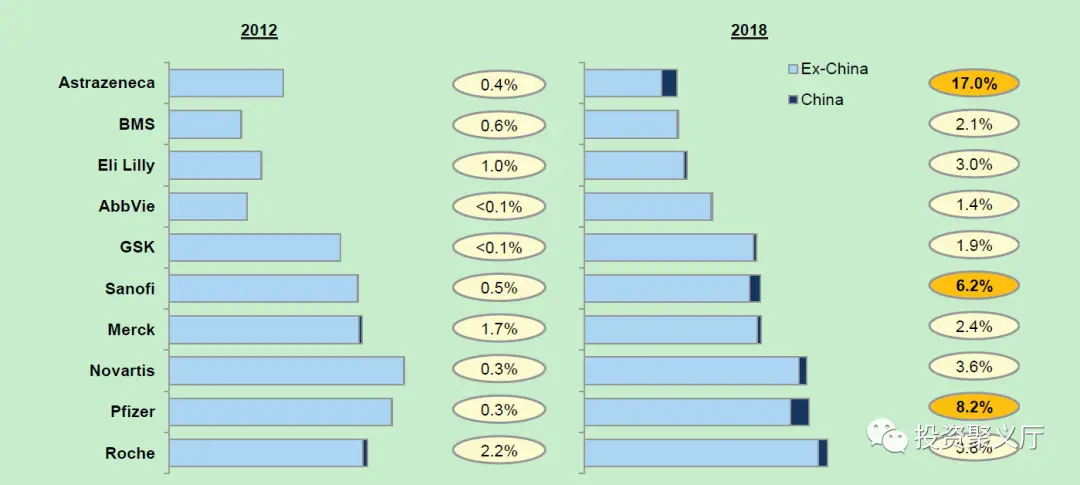
2015年以后我们看到中国已经成为国际制药巨头越来越重要的市场,跨国药企在全球的管线正在加速进入中国。目前在中国存在感较强的跨国药企,中国区的收入贡献在10%左右,其中以阿斯利康为最大,2019年有20%销售额来自中国。
中国现阶段创新药的模式主要是做me too、me better,在进度上如果能做到落后2年,已经是不容易的成绩。因为fast follow一般选择在同靶点领先分子的一期剂量爬坡阶段有了初步有效性/安全性数据时进行跟进。即使已经有了备选化合物,前面那些工作还是要做一遍,包括IND enabling、IND filing、开临床中心、一期单中心爬坡、随访,这些过程一切顺利,也基本要2年时间。
从目前研发投入的绝对金额和费用率上看,中国创新药企业还有较长的路要走。在这种情况下,引入一些国外药企的中国市场权益就变成了一种合理的商业模式。
宝哥:怎么识别公司在这方面的能力?
陈总:inlicense的能力分为前端选品种的能力,和引入后临床推进的能力。选品能力其实就是需要和真正做deal的人聊,理解他们的研究能力。如果研究员没有这个能力,那只能看结果,原来引进的品种后来在临床上怎么样了。
宝哥:这就像是消费品公司刚上新的时候让二级市场研究员判断这个新品会不会爆款,但这几乎不太可能,所以最后就是跟数。
陈总:也不一样,还是有生物学的框架可以指导。消费品有框架吗?
宝哥:也有一些,但都是后验的,套在下个都不晓得有没有用。
陈总:那药这块还是硬核science。
宝哥:仿药时代积累下的销售能力你觉得还有用吗?
陈总:仿制药的企业传统的销售优势在于市场准入、医院关系、医生客勤有较好的基础。仿制药集采以后就基本用不上这些优势了,但对早期创新药的销售还是有很大帮助。从长期来看,评价一个公司的销售能力会逐渐转向公司现有产品在该适应症领域的产品线丰富水平、科室深耕程度。
必须承认中国的公立医疗体系里,医生的薪酬被压制,药品在某种程度上其实承担了“补足医生利益”的历史使命。试图破除以药养医那么多年,医生的收入水平在逐渐提高,利益补足的形式也早已从现金这种比较low的方式转化到开学术会议,提供研究经费这样更体面的方式。
对于药企来说,能否让自己的销售方式伴随全行业行为方式的变化而变化,并且跟随药企自身产品线升级而升级,就体现了执行力。
以4家国产PD1为例:君实和信达均在18年底获批上市,在2019年全年分别实现了10亿和7.7亿的销售额。但2020年信达PD1进医保后,迅速完成了医院覆盖,并且单价低,成功吸引了大部分支付能力较弱的病人。上半年实现了9亿销售额,且在新病人数量上超过恒瑞。
恒瑞虽然获批遇到了一些阻碍,但是19年只销售5个月的情况下实现了11亿销售。虽然错过去年医保谈判机会,但是依靠强大的医院覆盖和较高的定价,主打高支付能力的病人群体,上半年也搞出16亿左右。
反观君实由于错失医保资格,在市场准入方面速度较慢,并且20年上半年销售团队稳定性出现波动,销售额仅为信达的一半。这几家的分化说明创新药企业的销售能力组建也不是一帆风顺的。
宝哥:在你眼中,同时具备创新药研发和销售能力的公司都有谁?
**陈总:**能打通创新药的研发(无论是inhouse研发还是inlicense)以及销售的公司,在目前中国的医药行业内处于非常有利的地位。这样的公司不超过10个,像是恒瑞、豪森、信达、百济、再鼎(刚在香港上的),或许以后君实也可以吧。
如果让我选,合理甚至偏贵点的价格投资这样的公司,比便宜的价格投资在某个环节有明显短板的企业,长期的收益应该会更高。
案例分析:再鼎医药
公司17年3季度在美国上市时,在中国做inlicense业务模式的企业并不多,彼时这种商业模式也并不为所有人看好。
这套商业模式的源动力是选到好的分子。公司在早期引进过一些不太成功的分子,但最核心的那个分子—Tesaro公司开发的Niraparib,在global临床开发过程中一路顺风顺水,成长为PARP这个靶点里比较确定的Best in class药物。再之后引进的Ripretinib,Repotrectinib都是各自靶点的best in class,可以说,公司在选品种上的能力以及得到了充分的验证。
有了好的molecule,接下来就是临床开发了。公司的两个重磅产品,Niraparib与电场治疗仪Optune,都在中国以最简洁的临床方式获批上市—其中Niraparib以PK bridging study上市,Optune豁免了临床。公司的临床团队与CFDA的沟通,以及政府事务能力在这当中起了主要作用。
销售方面,公司也是崭露头角。Niraparib在20年1月正式上市,在疫情的情况下,上半年完成了800家医院覆盖,接近1亿rmb的销售,在短短半年时间交出这样的答卷,也是比较令人欣喜的。
临床开发和销售能力其实是对选品种能力的一个重大帮助,构成了一个良性循环。Inlicense 这套模式很重要的一点是要partner给力,在global投大钱,探索更多的商业机会,这就需要这个品种对partner来说是最重要的。要想让人把最重要的资产的中国权益交给你打理,自然是需要在上述的各个环节都要拿得出手,毕竟中国做inlicense的企业很多。
对于Zai Lab来说,随着临床能力进一步提升,这条路是越走越宽,在一些重要产品的重要临床项目上,比如MGD013联合Margetuximab在胃癌中的探索性临床,公司会贡献较大比例的病人,在global临床开发中创造更大的价值。
3.创新药投资的不确定性
宝哥:药神上次也说了医药行业的政策周期非常重要,创新药的政策方面你觉得还有哪些重要变数?
陈总:
第一个还是医保的竞争性谈判机制。如果把竞争的维度外延到同适应症,这样的竞争可能会更加激烈。当然这样的竞争标准应该不会像丙肝药物这样进行集中谈判、淘汰的玩法,而是通过药物经济学来比较不同靶点的药物的性价比。
举个栗子:糖尿病在中国是一个1亿人口以上发病率的疾病,并且随着老龄化,长期会对医疗费用造成巨大负担。轻症的糖尿病治疗以口服降糖药为主。由于糖尿病临床试验随访长,需要验证心血管事件终点等严苛要求,在国际上新靶点的出现比较慢,国内的口服降糖药基本都以仿制药为主。
除了上市多年的双胍类,磺脲类,α糖苷酶类抑制剂,还有国内新上市的DPP4、SGLT2类药物。这些仿制药在集采情况下,价格大幅下降,日治疗费用基本都在5毛钱以下。即使是19年新上市的维格列汀(DPP4)仿制药,在刚完成的第三批国家仿制药集采里,价格也给你安排到每天2元以下。
那么对于一些创新口服糖尿病靶点,如华领医药的GKA,目前看起来临床效果与DPP4相当,但是在比较长的时间内,都无法获得心血管事件终点等严格的安全性数据。这样的创新药,医保如何去定价?
政策如何在有效性、安全性、经济性这三个核心指标的基础上,兼顾对国产创新的鼓励扶持,是一个需要重点观察的方向。
第二是药审机构对注册临床标准的要求。
注册临床主要分两种类型,一种是较为严格的,需要与现有标准疗法进行头对头比较,在主要临床终点体现出统计学非劣效或者优效。这样的试验一般时间长,投入大。
另一种是不需要对照,只需要通过单臂试验论证一下有效性,这种情况一般发生在试验药物的临床效果明显好于目前标准疗法的情况下。这种单臂试验,只要有效性落在预设的置信区间,以及足够例数的安全性试验就能支持获批。样本量远小于随机对照试验,投入低,产出快。
中国的单臂注册比美国更为普遍。从企业角度来说,超适应症使用的玩法在中国更普遍,都希望以冷门适应症的较小投入的单臂注册试验上市,在一些更大的适应症先进行销售。然后CFDA目前在单臂注册的尺度比美国松很多,在当下中国培育创新药企业的早期阶段,这样的尺度松有利于更多的企业培育团队,建立初步规模。但是长期来看,会导致产能过剩,浪费临床资源等问题。
在2019/20年CSCO大会上,药审中心的领导也严肃提出过这个问题:单臂注册不是不行,但是要在疗效或安全性上体现出明确的优势。
可预见的是注册临床标准会逐步提升,而且其实已经能从一些细节中感知到。比如某免疫双靶点单抗品种,之前选择了后线鼻咽癌作为注册临床,但是因为主要临床终点ORR的置信区间下限没有达到CFDA要求,被迫选择另一个适应症做单臂注册申报,产品上市进度受到影响。
宝哥:最后一个话题,怎么去把握创新药投资的周期性?
**陈总:**二级市场投资相比一级市场最吸引我的地方,就是对周期的重视。这里所说的周期,大到某个细分行业的供求周期,小到公司的产品上市周期、库存周期,并且会叠加上投资人的情绪周期,对公司的估值带来巨大波动。
在创新药投资兴起之前,判断这些周期目前处于什么位置,对于抓股价拐点,判断趋势有很重要的作用。历史上给我留下比较深刻印象的周期,一个是血制品2017年两票制叠加行业采浆量迅速增长带来的价格向下周期,还有就是各种原料药的供求关系带来的股价周期。
从本质上说,传统医药子行业(仿制药,中成药,血制品,原料药)的周期波动都是连续的,容易预判的。研究员通过更勤快的跟踪,调研,都能从周期波动中有所斩获。
而创新药的投资,尤其是涉及到新靶点、新机理的创新药,它的周期是跃迁的、不连续的,因为科学发展的本身是颠覆性的。在这种颠覆性的周期下,行业周期、公司产品周期、投资人的情绪周期被浓缩到一起,呈现在股价上就是极为剧烈的短期波动。这也意味着我们传统的投资方法论需要做出对应的调整。
这些不确定性对专业性更强的创新药投资人,一定是机遇大过挑战。需要仔细观察哪些企业的相对竞争力在优化。这也对我们的研究工作提出了更高的要求,需要有更大的全局观。
这种全局观体现在很多方面,比如不同靶点的生物学机理的研究进展;临床数据的比较需要横跨靶点、适应症,且需要基于对每种疾病的理解而非泛泛的数字对比;药审、医保政策的变化动向。这些要求都是对自己能力圈的考验。
宝哥:你感觉自己有这能力吗?
陈总:(邪魅一笑)
有些熟悉的靶点有,大部分靶点需要先学。这玩意非常难,方法论也不尽相同。
宝哥:那基金经理如果没有生科、药学背景,该怎么去吸收内化?
陈总:硬学or被淘汰or不碰。
医药以后的二级市场玩家一定是逐步洗牌的,一般的PM没法在医药里配置出超额收益,或者就随便配几个大的公司完事儿,但也很容易成为韭菜。
宝哥:…………
陈总:要么你还是搞器械吧,器械这种东西好一点,研究深度不深,对研究体系要求低。

